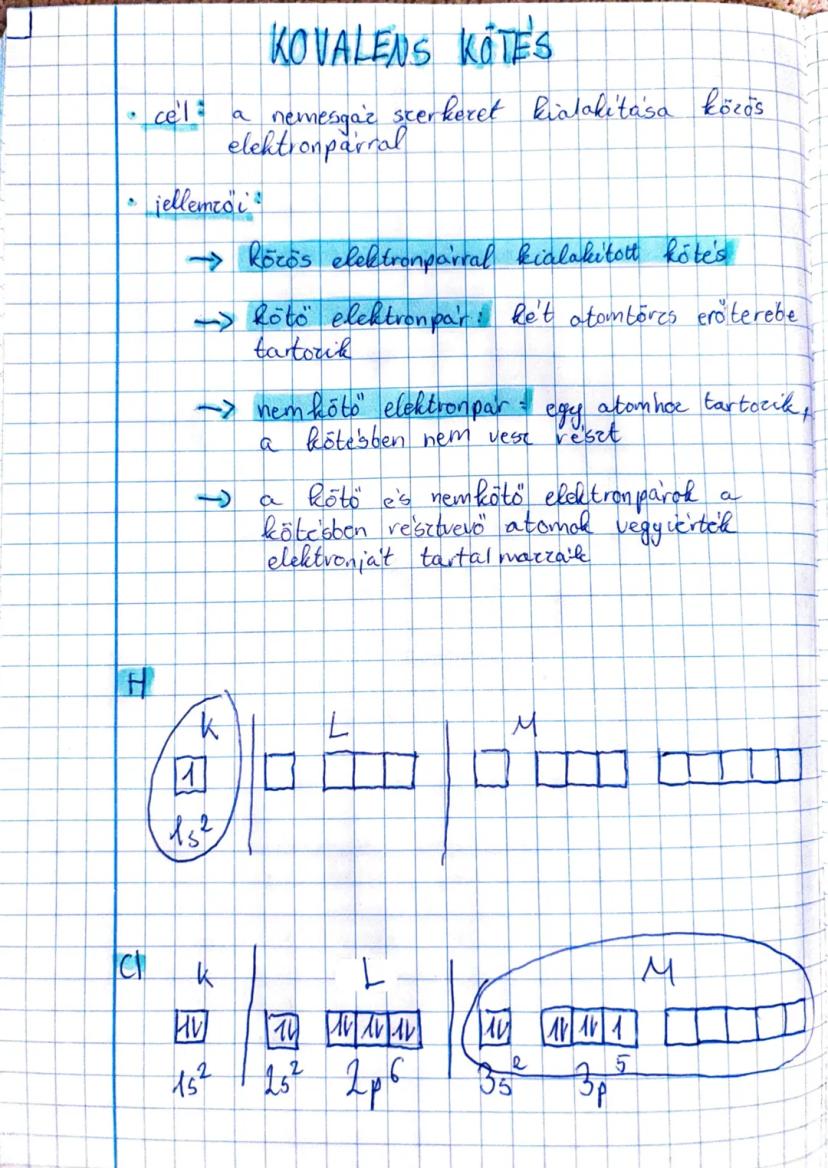
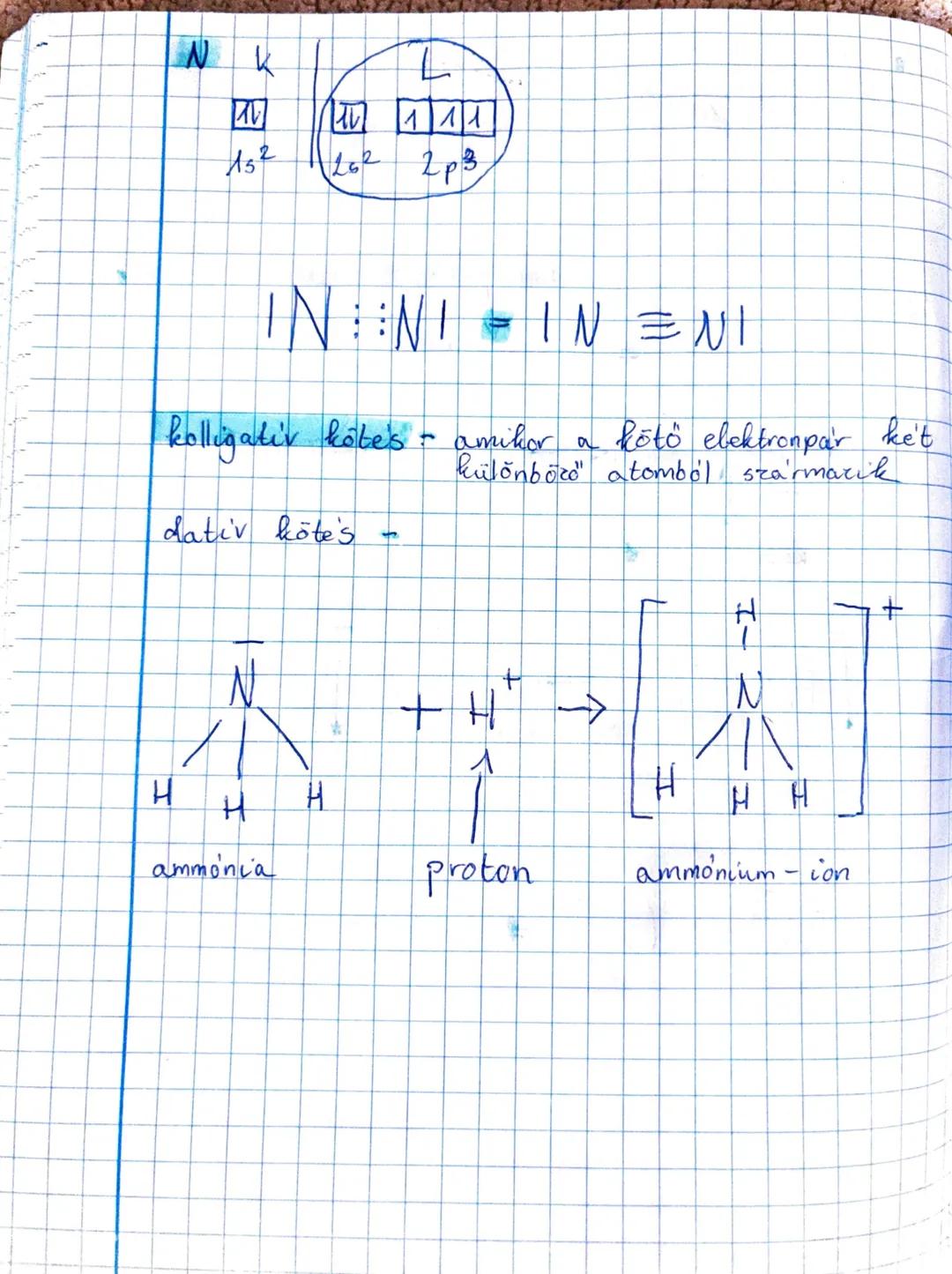
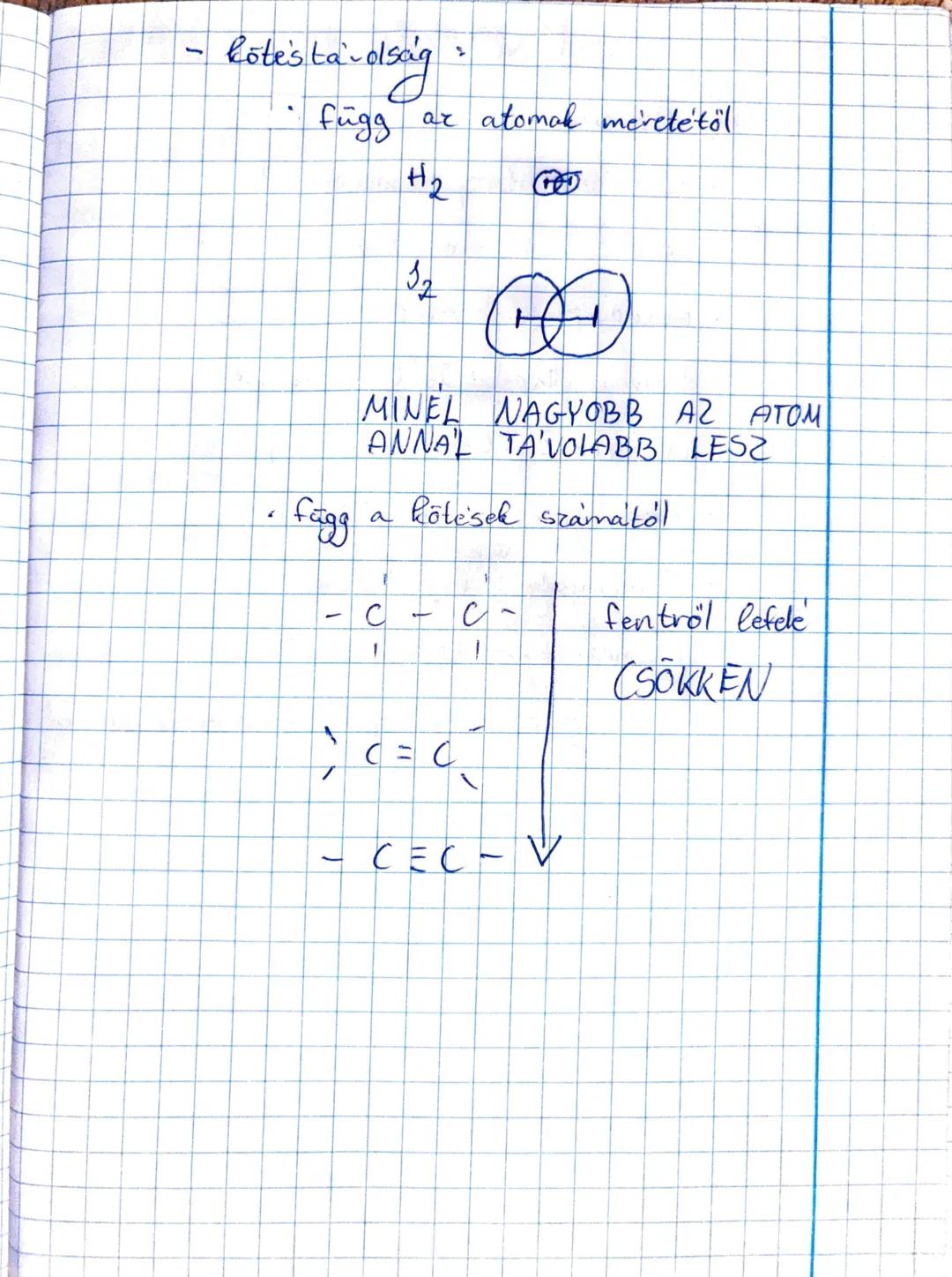
A kovalens kötésaz egyik legfontosabb kémiai kötéstípus, amelyben az... Továbbiak megjelenítése
Regisztrálj, hogy lásd a tartalmatTeljesen ingyenes!
Hozzáférés minden dokumentumhoz
Javítsd a jegyeidet
Csatlakozz diákok millióihoz
A regisztrációval elfogadod a Felhasználási Feltételeket és az Adatvédelmi Szabályzatot